محصولات پژوهشکده توسعه صنایع شیمیایی
معرفی محصولات تولید شده در پژوهشکده توسعه صنایع شیمیاییمحصولات پژوهشکده توسعه صنایع شیمیایی
معرفی محصولات تولید شده در پژوهشکده توسعه صنایع شیمیاییحقایقی جالب درباره جدول تناوبی عناصر
با تاسف باید گفت که جدول تناوبی برای دانش آموزان ما تنها یک درس معمولی در میان سایر دروس شیمی است. اما واقعیت این است که جدول تناوبی نقشه راهی بسیار ارزشمند برای دانشمندان در سراسر تاریخ کشف آن بوده است.
دمیتری مندلیف جدول تناوبی خود را در 6 مارس 1869 به انجمن شیمی روسیه ارائه کرد. گرچه او به عنوان مخترع جدول تناوبی شناخته میشود، لیکن جدول او اولین تلاش برای سازماندهی عناصر بر طبق خواص دوره ای آنها نبود. در 1864 لوتا مهیر یک جدول تناوبی ارائه کرد که دربر دارنده 28 عنصر شناخته شده بود.
در آن زمان دانشمندان برای تعیین وزن هرکدام از 63 عنصر شناخته شده، جریان برق را از محلولهای متعددی عبور میدادند تا آنها را به اتمهای تشکیل دهنده مواد مرکب تجزیه کنند. برای جداسازی اتمها از باتری استفاده می شد. با قرار دادن دو الکترود در محلول و وصل کردن آنها به قطبهای مخالف باتری، حلال به اتمهای مجزا شکسته شده و هر اتم بر حسب بار منفی یا مثبت خود بسوی الکترود مخالف می رفت. سپس این اتمها در ظرفهای مجزا گردآوری شده و توزین میشدند.
دمیتری مندلیف عاشق بازی با کارتها بود. او وزن هر عنصر را روی یک برگه جداگانه نوشته و همانند ورق بازی آنها را مرتب کرد. بدین ترتیب عناصری که دارای خواص مشابه بودند در یک ستون قرار میگرفتند.
یک ابداع مهم مندلیف این بود که اصرار داشت عناصر با خواص مشابه در یک ستون قرار بگیرند. ولی بدین صورت برخی خانههای جدول خالی میماند. توجیه مندلیف این بود که این خانهها به عناصری تعلق دارند که هنوز کشف نشدهاند. بدین صورت مندلیف توانست با استفاده از خواص عناصر بالای ستون، خواص عناصر کشف نشده را پیش بینی کند. تاریخ علم از این ابتکار مندلیف به عنوان یکی از بزرگترین کشفهای علمی یاد کرده است.
ولی مندلیف جایی برای عناصر عجیبی مانند آرگون که در 1894 کشف شد و نیز هلیوم، نئون، کریپنون و زنون پیش بینی نکرده بود. این گازهای بیاثر که در حالت عادی هیچ تمایلی برای انجام واکنش شیمیایی ندارند اکنون در آخرین گروه جدول تناوبی رده بندی شدهاند.
اتحادیه بینالملی شیمی محض و کاربردی (IUPAC) مسئول بروزآوری جدول تناوبی در صورت کشف عناصر جدید است. امروزه وجود 118 عنصر در جدول تناوبی تایید شده است که 90 تا از آنها در طبیعت یافت شده و بقیه تا اندازه زیادی ساخته دست بشر هستند. تکنسیوم (Technetium) اولین عنصری است که در 1937 در آزمایشگاه ساخته شد.
امروزه جدول تناوبی بر حسب افزایش عدد اتمی (تعداد پروتونهای هسته اتم) سازماندهی شده است در حالی که مندلیف آنها را بر حسب وزن اتمی (مجموع تعداد پروتونها و نوترونهای هسته) طبق بندی کرده بود.
تقریبا 75 درصد عناصر موجود، فلز هستند. فلزهای قلیایی، فلزهای قلیایی خاکی، فلزات بازی، فلزات انتقالی، لانتانیدها و آکتینیدها گروهای فلزات جدول تناوبی هستند.
اتم کربن از گروه 4 میتواند چهار پیوند کوالانسی (پیوندهایی که با اشتراک الکترون شکل میگیرند) با سایر عناصر و همچنین با خودش ایجاد کند. بدین ترتیب کربن میتواند با سایر اتمهای کربن ترکسب شده و مواد مرکب بسیار متنوعی با وزنهای مولکولی بالا بسازد. همچنین مولکولهای ایجاد شده می توانند ساختارهای سه بعدی متنوعی مانند حلقه ها و شبکه ها به خود بگیرند. این انعطاف پذیری کربن را به عنصری کلیدی در حیات زنده تبدیل کرده است.
بنا به محاسبات ریچارد فاینمن دانشمند بزرگ فیزیک اتمی، جدول تناوبی حداکثر 136 عنصر می تواند داشته باشد زیرا الکترونهای لایه آخر عنصر شماره 137 باید با سرعت نور به دور هسته بگردند. همچنین برای مثال الکترون شماره 139 باید سریعتر از نور به دور هسته بگردد که از نظر علمی غیرممکن است.
منبع:
https://interestingengineering.com/15-fun-and-surprising-facts-about-the-periodic-table-of-elements
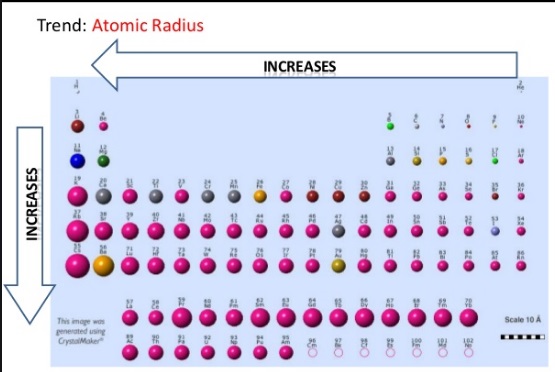
رابطه بین شعاع اتمی عناصر و جایگاه آنها در جدول تناوبی
جدول تناوبی عناصر را به گونه ای آرایش می دهد که ویژگی های شیمیایی و فیزیکی آنها به صورت روندهای مکرر ظاهر می شوند. این روندها را تنها با بررسی سریع جدول تناوبی می توان دریافت و توضیح آنها به توسط پیکربندی الکترونی عناصر صورت می گیرد. تمامی عناصر تمایل دارند با بدست اوردن یا از دست دادن الکترونهای ظرفیت، آرایش هشت تایی پایدار در لایه الکترونی آخر خود کسب کنند. دو روند مهم دیگر در جدول تناوبی قابل مشاهده است. نخست این که با حرکت از سمت چپ به راست جدول در طول یک دوره (سطر جدول)، الکترونها یکی یکی به اتم اضافه می شوند. بدین ترتیب با افزایش بار مثبت هسته و تعداد الکترونها، گیوند میان لایه های الکترونی و هسته اتم قوی تر می شود. دوم اینکه با حرکت به پایین در طول یک ستون در جدول تناوبی، پیوند میان لایه هیا بیرونی و هسته ضعیف تر می شود. این دو روند توضیح دهنده خواص مهمی مانند شعاع اتمی، انرژی یونیزاسیون، الکترونخواهی و الکترونگاتیویته هستند.
شعاع اتمی
شعاع اتمی یک عنصر به صورت نصف فاصله میات مراکز دو اتم یک عنصر که با هم تماس دارند، تعریف می شود. بطور کلی از چپ به راست در طول یک دوره شعاع اتمی کاهش افته و در طول یک گروه از بالا به پایین افزایش می یابد. عناصری با بزرگترین شعاع اتمی در گروه نخست و پایین جدول تناوبی جای دارند.
از چپ به راست در یک دوره، الکترونها یکی یکی به آخرین لایه انرژی اضافه می شوند. این الکترونها درون یک لایه هستند و نمی توانند اثر جاذبه هسته را بپوشانند. از انجایی که تعداد پروتونها نیز افزایش می یابد جاذبه هسته بر این لایه الکترونی افزایش یافته و شعاع اتمی کاهش می یابد.
با حرکت از بالا به پایین در طول یک گروه، تعداد الکترونها و لایه های الکترونی کامل شده افزایش می یابد لیکن تعداد الکترونهای ظرفیت (آخرین لایه) ثابت است. بدین ترتیب بر تعداد لایه های الکترونی افزوده شده و شعاع اتم فزونی می گیرد.
منبع:
https://www.thoughtco.com/periodic-properties-of-the-elements-608817